L’ectopia si riferisce a un oggetto o tessuto umano che si forma o si trova dove non appartiene. La formazione dell’osso ectopico consiste nella deposizione di nuovo materiale osseo (attraverso un processo chiamato ossificazione) nelle aree, ancora una volta, dove questo materiale non appartiene. Questo processo di ossificazione viene eseguito da cellule chiamate osteoblasti.
La parola ectopica viene dai greci e significa "via da un luogo". Il suo controsenso, che è l’osso "ortotopico" – anch’esso derivato dal greco – si riferisce all’osso che si forma nella sua corretta posizione anatomica, secondo Scott, et .
al., Nel loro articolo intitolato "Breve rassegna dei modelli di formazione dell’osso ectopico". L’articolo è stato pubblicato nel numero di marzo 2012 della rivista Stem Cells Development.
La formazione dell’osso ectopico può essere presente alla nascita, essere dovuta alla genetica o essere una complicazione di alcune condizioni mediche come la paraplegia e / o lesioni traumatiche (per nominarne solo alcune). Scott, et. al. affermare che la formazione ossea ectopica si pensa sia causata dall’infiammazione locale seguita da una riunione di cellule progenitrici scheletriche. Secondo il sito web del Boston Children’s Hospital, una cellula progenitrice è molto simile a una cellula staminale, tranne per il fatto che è più limitata in termini di tipi di cellule che può diventare quando si divide. Le cellule progenitrici provengono da cellule staminali ma non sono cellule staminali adulte.
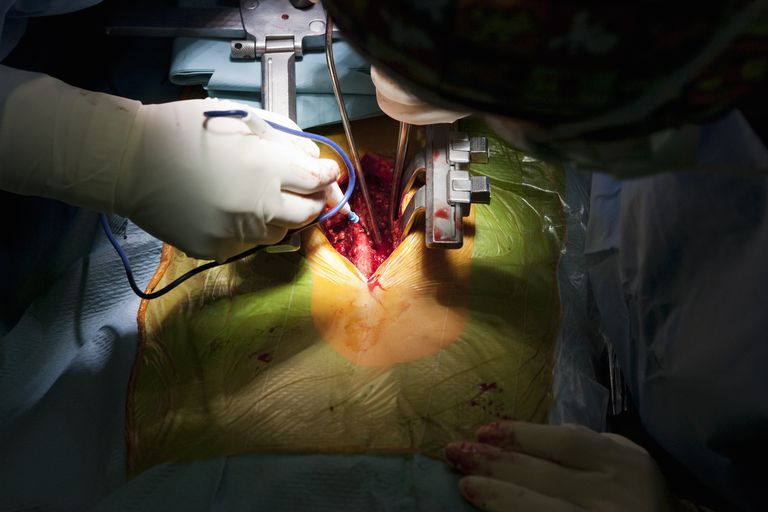
Formazione osso ectopico dovuta a chirurgia spinale
Scott, et. Al, dire che fino al 10% dei pazienti sottoposti a chirurgia invasiva – e la chirurgia posteriore sicuramente cade in questo gruppo – svilupperà la formazione ectopica dell’osso.
Nella colonna vertebrale, il termine "formazione ossea ectopica" è talvolta usato per descrivere il tessuto osseo indesiderato che viene depositato nel canale spinale. Nel 2002, la FDA ha approvato una proteina ossea prodotta da Medtronic chiamata Infuse per l’uso nella chirurgia della colonna lombare. I criteri di utilizzo specificati dalla FDA erano molto specifici: come innesto osseo per fusione interombalica anteriore monolaterale (ALIF) a livello singolo all’interno del sistema di dispositivi di fusione conica lombare (LT-Cage.) Whew!
Ma subito dopo l’approvazione, molti chirurghi hanno iniziato a usare il materiale "off-label", il che significa per scopi diversi da quelli approvati dalla FDA. Gli usi off-label comprendevano un intervento chirurgico alla colonna vertebrale cervicale che ha provocato una serie di "eventi avversi" o che l’AE veniva segnalato alla FDA. La formazione dell’osso ectopico era una delle AE, ma la lista includeva altre cose molto gravi come l’aracnoidite, l’aumento dei deficit neurologici, l’eiaculazione retrograda, il cancro e altro ancora. Non carino!
Medtronic Polemica
Il Rapporto Sentinal Watchdog Milwaukee Journal, che ha seguito questa storia a partire dal 2011 (e continua a farlo), dice che a poche settimane il primo studio clinico per Infuse, formazione ectopica è stata trovata nel 70% dei pazienti dello studio . Alcuni di questi pazienti richiedevano uno o più interventi chirurgici per correggere l’osso indesiderato e / o le complicazioni mediche che ne derivavano.
Nella sua recensione delle prove pubblicate nel numero 2013 di Surgery Neurology International, Epstein ha confrontato i 13 studi alimentati dall’industria con altri studi successivamente pubblicati su riviste, nonché con i documenti e le informazioni della FDA che si trovano nei database. Riferisce di aver trovato "eventi avversi e incoerenze interne originariamente non pubblicati" con gli studi Infuse.
Riferisce anche che il 40% degli eventi avversi erano attribuibili all’ALF (la chirurgia del collo "off-label" che era stata fatta), aggiungendo che alcuni di questi eventi erano pericolosi per la vita.
Nel frattempo, il Milwaukee Journal Sentinel riferisce che Medtronic ha sottovalutato o non ha affatto segnalato questi effetti avversi alla FDA in un rapporto del 2004 scritto da medici finanziati da Medtronic. MJS dice che i “dottori che ha scritto il documento del 2004 avrebbe continuato a ricevere milioni di dollari in royalties e altri pagamenti da Medtronic.”
Nel maggio del 2014, la MJS seguiti questa storia con un altro articolo dicendo Medtronic aveva accettato di pagare 22 milioni di $ per risolvere 1000 reclami contro il loro infuso.
La storia ha anche detto che la Medtronic sta mettendo da parte altri $ 140 per coprire "pretese attese".

