Panoramica
Humira è un anticorpo monoclonale completamente umanizzato. Ciò significa che, anche se è prodotto in sistemi biologici non umani, l’effettiva composizione proteica del farmaco è identica a quella degli anticorpi umani. E questo distinto Humira dal bloccatore di anticorpo monoclonale TNF che è stato approvato prima di esso – la sua composizione proteica è stata derivata in parte da un anticorpo non umano (topo).
Nel 2002, Humira è stata inizialmente approvata dalla Food and Drug Administration (FDA) statunitense come trattamento per l’artrite reumatoide. È uno dei numerosi farmaci biologici che bloccano il TNF-alfa, tra cui:
Enbrel (Etanercept): il primo farmaco anti-TNF approvato dalla FDA per l’artrite reumatoide e alcuni tipi infiammatori di artrite nel 1998.
- Remicade (Infliximab): Il secondo inibitore del TNF deve essere approvato dalla FDA nel 1999.
- Simponi (Golimumab): approvato dalla FDA il 24 aprile 2009.
- Cimzia (Certolizumab Pegol): approvato dalla FDA il 14 maggio 2009.
- Dosaggio
Humira è somministrato mediante autoiniezione sottocutanea (sotto la pelle) una volta ogni due settimane. I pazienti possono essere informati dal loro medico di iniettarlo ogni settimana se ogni 14 giorni non è sufficiente.
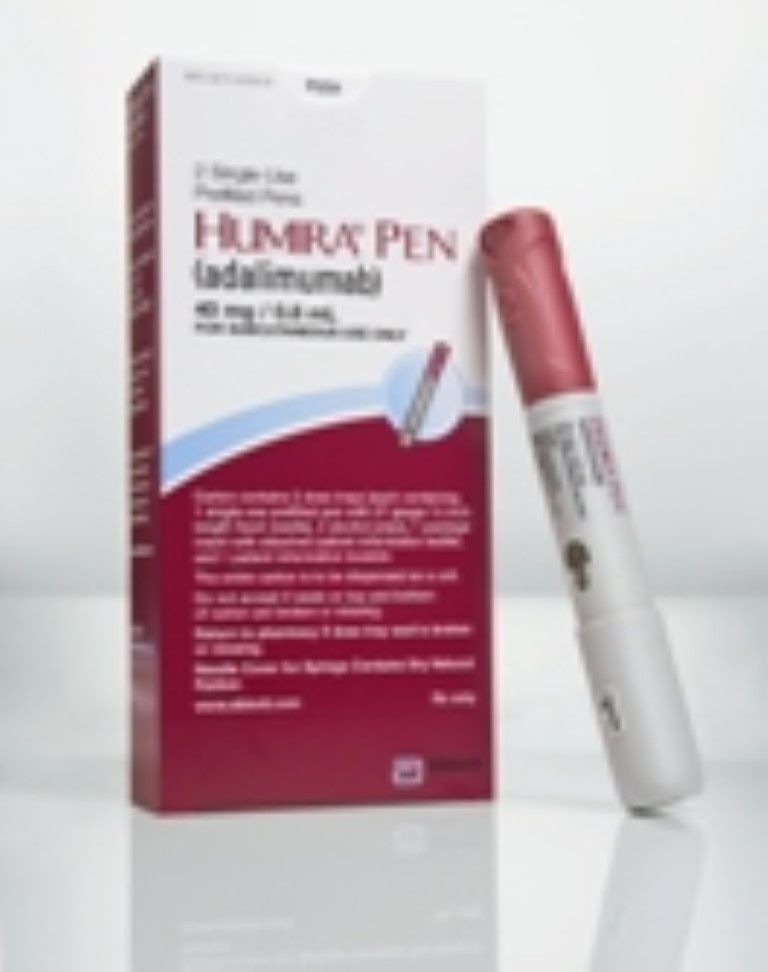
È stato inizialmente disponibile in una siringa preriempita monouso. Un singolo uso, il sistema di consegna usa e getta è stato sviluppato, noto come la penna Humira. Every La dose raccomandata, tuttavia, è di 40 mg come autoiniezione sottocutanea utilizzando la siringa pre-riempita o la penna Humira ogni due settimane. Metotrexato, altri DMARD non biologici, glucocorticoidi, farmaci anti-infiammatori non steroidei (FANS) o analgesici (farmaci per il dolore) possono essere proseguiti durante il trattamento con Humira. Tuttavia, non dovrebbero essere usati altri DMARD biologici.
Indicazioni Hum Sono state aggiunte ulteriori indicazioni per Humira da quando è stato inizialmente approvato dalla FDA. Può essere prescritto anche per trattare:
Artrite reumatoide Sp Spondilite anchilosante
Artrite psoriasica Ar Artrite idiopatica giovanile Ps Psoriasi a placche
Colite ulcerosa Dis Malattia di Crohn in età adulta e pediatrica
- Hidradenitis Suppurativa
- Effetti collaterali
- Gli effetti indesiderati comuni associati a Humira includono:
- Lieve reazione al sito di iniezione
- Rash
- Mal di testa
- Mal di stomaco o nausea
- Polmonite
Reazioni avverse
Poiché sopprime la risposta immunitaria nel corpo che normalmente combatte l’infezione, Humira è stato associato a infezioni gravi, come tubercolosi, sepsi e infezioni fungine . Può anche peggiorare i sintomi di malattie del sistema nervoso (ad es. Disturbi demielinizzanti). Negli studi clinici, alcuni pazienti avevano tassi più elevati di cancro e linfoma per un periodo di 24 mesi.
- Chi non deve prendere Humira
- Humira non deve essere utilizzato da pazienti con allergia nota al farmaco o ai suoi componenti. Inoltre, non deve essere usato da pazienti in gravidanza o allattamento.
- Il farmaco non deve essere prescritto per un paziente che ha un’infezione attiva o per i pazienti che sono predisposti alle infezioni, compresi i pazienti con diabete non controllato o pazienti con una storia di infezioni ricorrenti.
- Informi il medico
- Se hai un’infezione attiva
Se sei stato infettato da epatite B o sei un portatore (Humira è stato associato alla riattivazione dell’epatite B)
Se ha intorpidimento, formicolio o sclerosi multipla o un disturbo del sistema nervoso centrale
Se è stato trattato per insufficienza cardiaca
Prima di ricevere qualsiasi vaccino o intervento chirurgico
Per segnalare sospette reazioni avverse, è possibile contattare AbbVie Inc.at 1-800- 633-9110 o FDA a 1-800-FDA-1088 o www.fda.gov/medwatch.