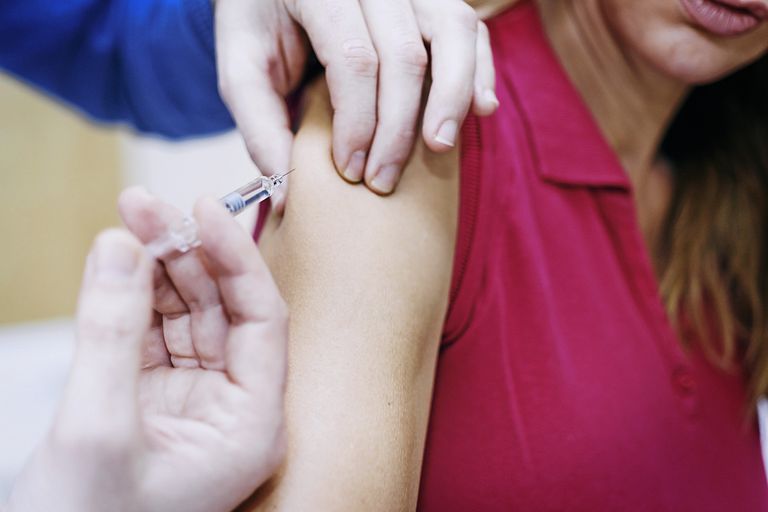
Heplisav-B è un vaccino usato per prevenire tutti i sottotipi di epatite B. È stato approvato dalla Food and Drug Administration (FDA) degli Stati Uniti il 9 novembre 2017 per utilizzare negli adulti dai 18 anni in su.
È uno dei tre vaccini attualmente utilizzati per prevenire l’infezione dal virus dell’epatite B (HBV) negli Stati Uniti. Questi includono Recombivax HB, che è stato approvato dalla FDA nel 1986, e il leader di mercato Engerix-B, che ha ottenuto un’omologazione simile nel 2007.
(C’è anche un terzo vaccino combinato, noto come Twinrix, che vaccina sia contro l’epatite A che B.)
Uno dei principali vantaggi di Heplisav-B è che richiede un numero minore di iniezioni in un periodo di tempo più breve, un fattore che può aiutare le persone a completare la serie piuttosto che a fermarsi.
Preoccupazioni iniziali sulla sicurezza
L’approvazione di Heplisav-B ha bloccato una battaglia durata quattro anni per portare il vaccino sul mercato. La FDA aveva precedentemente respinto il farmaco nel febbraio 2013 e successivamente nel novembre 2016 a causa di problemi di sicurezza riguardanti il potenziale rischio di infarto miocardico acuto (attacco di cuore) e alcune malattie autoimmuni.
Il vaccino è stato infine approvato sulla base in gran parte del fatto che richiede due colpi consegnati a distanza di un mese. Gli altri vaccini, al contrario, richiedono tre colpi separati da un mese e poi da sei mesi.
Questo è stato considerato importante poiché uno dei maggiori ostacoli alla vaccinazione contro l’HBV è stato l’adesione.
Uno studio del 2008 del Dipartimento di Malattie Infettive dell’Università della Florida a Jacksonville ha riferito che, di 707 persone ammissibili per la vaccinazione contro l’HBV, solo 503 hanno avuto accesso al trattamento e solo 356 hanno completato la serie a tre colpi. Altri studi hanno riportato risultati altrettanto tristi.
Riducendo il divario tra le iniezioni, la FDA ritiene che i benefici del vaccino superano di gran lunga qualsiasi potenziale conseguenza.
Efficacia
L’approvazione di Heplisav-B è stata basata su dati di tre studi clinici che hanno coinvolto oltre 14.000 partecipanti adulti. Lo studio principale ha confrontato un ciclo a due dosi di Heplisav-B con una serie di tre dosi di Engerix-B. Tra i 6.665 partecipanti coinvolti nello studio, il 95% ha raggiunto livelli elevati di protezione da Heplisav-B (misurato dall’attività anticorpale) rispetto all’81% di Engerix-B.
In un secondo studio che ha coinvolto 961 persone con diabete di tipo 2 (considerato ad alto rischio di epatite B), Heplisav-B è stato segnalato per fornire una protezione di alto livello nel 90% di quelle somministrate al vaccino contro solo il 65% in quelle date Engerix-B.
Inoltre, Heplisav-B è noto per fornire protezione contro tutti e quattro i principali sierotipi, dieci genotipi (da A a J) e 40 subgenotipi.
Somministrazione
Heplisav-B viene somministrato per iniezione intramuscolare nel muscolo deltoide superiore della spalla. Il vaccino non è un vaccino vivo (contenente virus vivi, indebolito) ma contiene invece un antigene geneticamente modificato, essenzialmente un avatar per il virus, che non provoca la malattia ma stimola piuttosto una risposta immunitaria protettiva.
Dopo aver ricevuto la prima iniezione da 0,5 millilitri (ml), un secondo sarà consegnato in sei mesi.
Se, per qualsiasi motivo, non si è in grado di completare la serie entro quel tempo, parlare con il proprio medico circa la finalizzazione delle serie il più presto possibile. È improbabile che tu debba riavviare la serie.
Reazioni avverse
Mentre alcune persone possono provare una reazione allo scatto, la maggior parte dei casi è lieve e risolve entro pochi giorni. In generale, le reazioni, se presenti, tendono ad essere più profonde dopo il primo colpo e meno dopo il secondo.
I sintomi più comuni (che si verificano in più del due percento dei pazienti) includono:
- Gonfiore nel sito di iniezione – 2,3 percento
- Rossore nel sito di iniezione – 4,1 percento
- Malessere – 9,2 percento
- Mal di testa – 16,9 percento
- Fatica – 17,4 percento
- Dolore nel sito di iniezione – 38,5%
Controindicazioni
Heplisav-B non deve essere usato in persone con una storia di reazioni allergiche gravi o che hanno avuto una precedente reazione a un vaccino contro l’epatite B o uno qualsiasi dei suoi componenti, incluso il lievito. La ri-esposizione potrebbe causare una reazione allergica di tutto il corpo potenzialmente pericolosa per la vita nota come anafilassi.
Ad oggi, non sono stati condotti studi sull’effetto di Heplisav-B durante la gravidanza o l’allattamento. Tuttavia, uno studio su animali non ha riportato eventi avversi nei ratti di laboratorio gravide o nella loro prole dopo una dose di 0,3 mL di Heplisav-B.
Chi dovrebbe essere vaccinato
L’epatite B è una malattia virale del fegato che può diventare cronica e portare a cirrosi, cancro del fegato e morte.
Secondo un rapporto della Task Force dei servizi di prevenzione degli Stati Uniti (USPSTF), ovunque da 700.000 a 2.2. Si ritiene che milioni di persone siano infette da HBV negli Stati Uniti. I tassi di infezioni sono più alti tra gli adulti da 30 a 49, la maggior parte dei quali viene infettata da sesso non protetto o uso di ago condiviso.
Non esiste una cura per l’epatite B, ma una vaccinazione efficace può prevenire la malattia. Per questo motivo, il comitato consultivo sulle pratiche di immunizzazione (ACIP) e attualmente raccomanda che tutti i bambini ricevano la loro prima dose di vaccino HBV alla nascita e completino la serie tra sei e 18 mesi. Anche i bambini più grandi e gli adolescenti che non hanno ricevuto il vaccino HBV devono essere vaccinati.
I Centri per il controllo e la prevenzione delle malattie raccomandano inoltre che tutti gli adulti ad alto rischio di HBV siano vaccinati. Questi includono:
- Persona che vive o ha rapporti sessuali con qualcuno che ha l’epatite B
- Persone sessualmente attive che non sono in una relazione a lungo termine reciprocamente monogama
- Persone che cercano test o trattamento per un’infezione trasmessa sessualmente
- Uomini che hanno rapporti sessuali con uomini
- Persone che vivono con l’HIV
- Persone che condividono aghi, siringhe o altri strumenti correlati alle droghe
- Operatori sanitari e altri soggetti a rischio di esposizione al sangue
- Persone con malattie renali allo stadio terminale
- Persone con malattie croniche del fegato
- Persone con diabete al di sotto dei 60, iniziato il più presto possibile dopo la diagnosi
- Viaggiatori internazionali verso regioni con tassi di epatite B moderati o elevati
- Persone che sono immigrate da paesi con tassi di epatite B moderati o elevati o figli nati da genitori immigrati da questi paesi prima di la loro nascita
- Chiunque si consideri a rischio
L’USPST attualmente non raccomanda la vaccinazione contro l’HBV per i generi l popolazione adulta in quanto non è stato dimostrato che la pratica riduca il rischio di malattie o morte per malattia del fegato.
Esaminare le preoccupazioni in materia di sicurezza
Nonostante l’accoglienza largamente positiva da parte dei funzionari della sanità pubblica, i problemi di sicurezza continuano ad affliggere il vaccino a causa dei suoi primi rigetti da parte della FDA. In La FDA ha inizialmente respinto il vaccino nel 2013 basandosi su uno dei suoi componenti, noto come CpG 1018. Questo è il composto usato per potenziare le capacità di attivazione immunitaria del vaccino e quello che abilita la serie a due colpi.
Secondo la risposta della FDA, si ritiene che CpG 1018 abbia il potenziale per innescare alcune malattie autoimmuni, tra cui la malattia della tiroide. Sebbene i primi studi non mostrassero differenze statistiche tra Heplisav-B e Engerix-B, l’applicazione è stata negata semplicemente perché le dimensioni dello studio erano considerate troppo piccole.
Al momento della riapplicazione, 14.238 persone erano state esposte al vaccino con solo due casi di tiroidite di Hashimoto (una forma di malattia della tiroide) e un caso di vitiligine segnalato.
Successivamente, nel 2016, il vaccino è stato respinto anche quando uno studio ha riportato un numero di eventi cardiaci maggiore del previsto, inclusi attacchi di cuore. In questo caso, la FDA ha richiesto ulteriori informazioni su eventuali fattori non associati che potrebbero aiutare a spiegare meglio i risultati.
Dopo aver esaminato i dati aggiuntivi, la FDA ha ottenuto l’approvazione. I risultati finali dello studio hanno riportato un rischio dello 0,1% di infarto in persone a cui è stato somministrato Heplisav-B contro lo 0,2% di Engerix-B.

